
Científicos de la Emory University de Estados Unidos han desarrollado un método de visualización de los movimientos y las fuerzas mecánicas de la superficie de las células.
Según publica dicha Universidad en un comunicado este sistema, que ha proporcionado ya la primera visión detallada de dichas fuerzas a nivel celular y a tiempo real, podría ayudar en un futuro a la detección y el tratamiento de enfermedades relacionadas con las células, como el cáncer.
Uno de los autores de la investigación, el profesor de química biomolecular de la Emory University, Khalid Salaita, explica en dicho comunicado que gracias a su método ahora “se puede medir algo que nunca antes se había medido: la fuerza que las moléculas aplican a otras moléculas, a través de toda la superficie de las células vivas, mientras las células se mueven y realizan sus procesos corrientes”. Además, los investigadores han logrado observar estas fuerzas en una película con transcurso de tiempo.
Todo ha sido posible gracias a una técnica de sensor fluorescente, desarrollada por el propio Salaita en colaboración con los estudiantes Daniel Stabley, Carol Jurchenko y Stephen Marshall.
Salaita explica que “las células están constantemente tirando y empujando de su entorno, e incluso pueden comunicarse unas con otras a través de su mecánica. Una de las formas en que las células usan estas fuerzas se evidencia a partir de las características de la arquitectura de su tejido, pero si queremos comprender realmente cómo funcionan las células, debemos entender la mecánica celular a un nivel molecular”.
Para ello, en primer lugar es necesario medir la tensión aplicada en la superficie celular a receptores celulares específicos, añade el científico. Los receptores celulares son proteínas o glicoproteínas presentes, entre otros rincones celulares, en la membrana plasmática que engloba a las células.
Estas proteínas hacen posible la interacción de determinadas sustancias con los mecanismos del metabolismo celular. Por ejemplo, a los receptores se unen sustancias químicas llamadas moléculas señalizadoras, como las hormonas o los neurotransmisores, para desencadenar una serie de reacciones en el interior de las células.
Primera evidencia directa de las fuerzas celulares
Salaita y su equipo aplicaron su técnica a un receptor específico: el receptor del factor de crecimiento epidérmico o EFGR. Este receptor está implicado en la síntesis de ADN y la proliferación celular, y constituye una de las vías de señalización celular más estudiadas.
Los investigadores cartografiaron concretamente la tensión mecánica ejercida por el EGFR durante los estadios iniciales de la endocitosis, un proceso que consiste en la introducción por parte de la célula de moléculas grandes o partículas en una vesícula, que termina por desprenderse de la membrana para incorporarse al citoplasma.
El momento de la endocitosis registrado fue aquél en el que el receptor celular capta ligandos o señales extracelulares que se unen a los receptores celulares, posibilitando la comunicación celular.
Los resultados obtenidos de este registro demostraron que las células no absorben pasivamente estos ligandos, sino que tiran físicamente de ellos hacia su interior. Este hallazgo supone la primera evidencia directa de la aplicación de fuerza mecánica celular al inicio de la endocitosis.
Características de la técnica
La cartografía de las fuerzas mecánicas celulares resulta importante porque podría ayudar a diagnosticar y a tratar enfermedades relacionadas con los mecanismos celulares.
Por ejemplo, se sabe que las células cancerígenas no se mueven igual que las células normales, pero aún no está claro si esta diferencia es causa o efecto de la enfermedad.
Salaita explica que se sabe “que si el EGFR está hiperactivo, se puede producir el cáncer, y que una de las vías de activación del EGFR es a través de la captación de ligandos”. Por tanto, si se pudiera comprender bien cómo las fuerzas mecánicas de los EGFRs juegan un papel en el desarrollo de esta enfermedad, sería posible diseñar medicamentos destinados a modificar este proceso mecánico y, en consecuencia, a detenerla”.
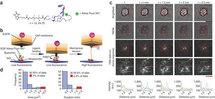
En los últimos años, se han desarrollado varios métodos para el estudio de los mecanismos de las fuerzas celulares, pero éstos han presentado importantes limitaciones. En el caso de uno de ellos, el de la ingeniería genética, es necesario agrietar y modificar las proteínas celulares, lo que conlleva cambios en el comportamiento de las células y, como consecuencia, resultados de investigación sesgados.
Por el contrario, la técnica desarrollada por los científicos de la Universidad de Emory es no-invasiva y no modifica las células. Además, para su aplicación sólo se necesita un microscopio de fluorescencia estándar, en cuyos dos extremos se sitúa un polímero flexible químicamente modificado.
Uno de los extremos del polímero lleva un sensor de fluorescencia activo que se une a un receptor de la superficie celular. El otro extremo está anclado químicamente a la platina del microscopio.
Cuando se produce una fuerza mecánica en la célula, el polímero se expande y la señal fluorescente de su sensor se activa, aumentando su brillo. La medición de la cantidad de luz fluorescente emitida permite conocer la cantidad de fuerza mecánica ejercida a nivel celular.
Grandes posibilidades
Esta nueva técnica hará posible la medición de las fuerzas mecánicas de cualquier proteína o molécula individual en la superficie celular, con una resolución espacial y temporal mayor de la alcanzada hasta ahora, señala Salaita.
Con ella, podrían desentrañarse por eso muchos de los misterios que plantean las células a la biología y a la química: podría saberse cómo avanzan las células cancerígenas cuando un tumor se expande, cómo están implicadas estas fuerzas en la división celular y en la respuesta inmune o podrían conocerse los mecanismos que permiten a grupos de células cardiacas latir al unísono.
Según Salaita: “nuestro método podría ser aplicado a casi cualquier receptor (celular), por lo que abre una vía para el estudio de las interacciones mecánicas y químicas de miles de receptores asociados a las membranas celulares de las superficies de prácticamente cualquier tipo de célula. Esperamos que la medición de las fuerzas celulares llegue a formar parte del repertorio estándar de técnicas bioquímicas utilizado por los científicos para estudiar los sistemas vivos”. Los resultados de esta investigación han aparecido detallados en la revista Nature Methods.














Hacer un comentario