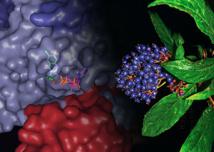
El misterioso funcionamiento interno del Chang Shan -la medicina china a base de hierbas utilizada durante miles de años para tratar la fiebre causada por malaria- ha sido descubierto gracias a una estructura de alta resolución resuelta por el Instituto de Investigación Scripps (TSRI, La Jolla, California, EE UU).
Descrita en la revista Nature, la estructura muestra en «detalle atómico» cómo funciona un compuesto de dos cabezas derivado del ingrediente activo del Chang Shan. Los científicos sabían desde hace tiempo que este compuesto, llamado halofuginona (un derivado de la febrifugina, puede suprimir partes del sistema inmune, pero nadie sabía exactamente cómo.
La nueva estructura muestra que, como una llave en las obras, la halofuginona atasca los engranajes de una máquina molecular que lleva a cabo la «aminoacilación», un proceso biológico crucial que permite a los organismos sintetizar las proteínas que necesitan para vivir. Chang Shan, también conocido como Dichroa febrifuga Lour, probablemente ayuda contra las fiebres de la malaria porque trazas de una sustancia química similar a la halofuginona presente en la planta interfieren siguiendo el mismo proceso en parásitos de la malaria, matándolos en el torrente sanguíneo de una persona infectada.
«Nuestros nuevos resultados resuelven un misterio que intrigaba a la gente, sobre el mecanismo de acción de un medicamento que se ha utilizado para tratar la fiebre de una infección de malaria que se remonta probablemente 2.000 años atrás o más», señala el profesor Paul Schimmel, en la nota de prensa del TSRI.
La halofuginona ha estado presente en ensayos clínicos para el cáncer, pero la imagen de alta resolución de la molécula sugiere que tiene una modularidad que lo hacen especialmente útil como plantilla para crear nuevos fármacos para muchas otras enfermedades.
El proceso de aminoacilación
La aminoacilación es un paso crucial en la síntesis de proteínas, los productos finales de la expresión génica. Cuando se expresan los genes, su secuencia de ADN primero se lee y se transcribe en forma de ARN, una molécula similar. El ARN se traduce después en proteínas, que son químicamente muy diferentes de ADN y ARN, pero están compuestas de cadenas de moléculas de aminoácidos enlazadas entre sí en el orden prescrito por el ADN.
Para este proceso de traducción es necesario un conjunto de moléculas conocidas como ARN de transferencia (ARNt), que transporte los aminoácidos a la cadena de proteínas que se está creando, en los que se agregan como las perlas de un collar. Pero antes de que los tRNAs puede mover las «perlas» a su lugar, primero tienen que agarrarlas.
La aminoacilación es el proceso biológico por el cual las perlas del aminoácido se unan a estas lanzaderas de tRNA. Una clase de enzimas conocidas como aminoacil-tRNA sintetasas es responsable de la unión de los aminoácidos con los tRNAs, y Schimmel y sus colegas han estado examinando los detalles moleculares de este proceso durante años.
Con el tiempo el cuadro que ha quedado de este proceso básicamente se reduce a tres agentes moleculares: un tRNA, un aminoácido y la enzima sintetasa aminoacil-tRNA que los une. Una cuarta molécula llamada ATP es una forma microscópica de combustible que se consume en el proceso.
El nuevo trabajo muestra que la halofuginona consigue su potencia al interferir con la enzima de ARNt sintetasa que une el aminoácido prolina al ARNt apropiado. Esto se logra mediante el bloqueo del sitio activo de la enzima donde se unen el tRNA y el aminoácido, con cada mitad de la halofuginona bloqueando un lado o el otro.
Curiosamente, añade Schimmel, la ATP también es necesaria para que enlace la halofuginona. Nada así se había visto nunca antes en la bioquímica. «Este es un ejemplo notable de cómo un sustrato de una enzima (ATP) captura un inhibidor de la enzima misma, por lo que se tiene un complejo enzima-sustrato-inhibidor», dijo Schimmel.
Referencia bibliográfica:
Huihao Zhou, Litao Sun, Xiang-Lei Yang and Paul Schimmel: ATP-Directed Capture of Bioactive Herbal-Based Medicine on Human tRNA Synthetase. Nature. DOI: dx.doi.org/10.1038/nature11774.


















Hacer un comentario