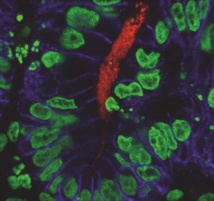
Científicos del Centro Médico del Hospital Infantil de Cincinnati (Ohio, EE.UU.) han logrado reproducir tejido gástrico humano con células madre pluripotentes, capaces de transformarse en cualquier tipo de tejido. Gracias a sus nuevos miniestómagos, la ciencia cuenta a partir de ahora con una herramienta más para investigar cómo se desarrollan las enfermedades relacionadas con el tracto digestivo, desde el cáncer hasta la diabetes.
Las imágenes de los nuevos miniórganos, publicadas, junto con el resto del trabajo, en la revista Nature, muestran cómo las células madre simulan una versión en miniatura del tejido de un estómago humano.
“Hemos manipulado el entorno en el que cultivamos las células madre para imitar el ambiente de un embrión en las etapas clave del desarrollo del estómago”, explica a Sinc Jim Wells, investigador principal del departamento de Desarrollo Biológico y Endocrino en el Hospital infantil de Cincinnati y coautor del estudio.
Esta es la primera vez que se genera tejido gástrico humano de manera molecular. “Nunca nadie había generado células gástricas a partir de células madre”, explica Wells. “Hemos descubierto cómo promover la formación de tejido gástrico tridimensional con arquitectura compleja”.
La clave para hacer crecer los organoides fue conocer, paso a paso, el proceso de formación de un estómago durante el desarrollo del embrión. Simulando este proceso en una placa de Petri, los científicos obligaron a las células madre a convertirse en las de un estómago. En un mes se había formado el tejido, que tenía un tamaño de 3 milímetros de diámetro.
“Hasta ahora, el principal problema a la hora de estudiar enfermedades relacionadas con el estómago ha sido la falta de modelos de laboratorio para simular la biología humana”, afirma Wells. Los modelos de ratón presentan carencias para investigar patologías digestivas de los humanos, por las diferencias entre especies en el desarrollo de los embriones y la arquitectura del estómago adulto.
Para empezar a experimentar con los miniestómagos de laboratorio, los investigadores, en colaboración con la Escuela de Medicina de la Universidad de Cincinnati, infectaron estos tejidos artificiales con la bacteria H. pylori, la principal causa de úlcera péptica y cáncer de estómago.
Impresionados
Wells y sus colegas quedaron impresionados por la rapidez con la que la bacteria H. pylori recubrió los tejidos epiteliales –que poseen una o varias capas de células unidas entre sí– del estómago infectado.
Tras 24 horas, la bacteria había activado los cambios bioquímicos del órgano, y el tejido imitaba a la perfección las primeras etapas de la enfermedad gástrica causada por la bacteria, incluida la activación de un gen del cáncer de llamado c-Met y la rápida propagación de la infección en los tejidos epiteliales.
Los investigadores tuvieron que combinar los trabajos ya publicados con los estudios de su propio laboratorio para responder a una serie de preguntas básicas sobre el desarrollo y formación del estómago.
“Este hito no habría sido posible si no hubiéramos dispuesto de investigación básica previa de otros científicos para entender el desarrollo embrionario del órgano”, explica Wells.
Antes hubo "minirriñones" y microcerebros
En 2013, científicos del Centro de Medicina Regenerativa de Barcelona (CMRB), del Salk Institute de California y del Hospital Clínic de Barcelona también lograron crear en laboratorio estructuras biológicas "mini", en este caso renales.
Los investigadores desarrollaron en aquella ocasión unos “minirriñones” destinados a facilitar la investigación de las enfermedades renales y el descubrimiento de nuevos fármacos. Lo hicieron utilizando células madre humanas.
Recientemente, además, otros equipos investigadores han descrito la creación de primordios (estado rudimentario en que se encuentra un órgano en formación) de cerebro y de hígado a partir de este mismo tipo de células: un grupo japonés desarrolló así yemas de hígado funcionales, y un equipo de Viena microcerebros.
Referencia bibliográfica:
James M. Wells et al.: Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature (2014). DOI: http://dx.doi.org/10.1038/nature13863.

















Hacer un comentario